Disminución de la presión en un recipiente en el que reacciona dióxido de carbono con una disolución básica
Downloads
- PDF (Español (España)) 8899
- EPUB (Español (España)) 144
- VISOR (Español (España))
- MÓVIL (Español (España))
Additional Files
DOI
https://doi.org/10.25267/Rev_Eureka_ensen_divulg_cienc.2018.v15.i3.3401Info
Abstract
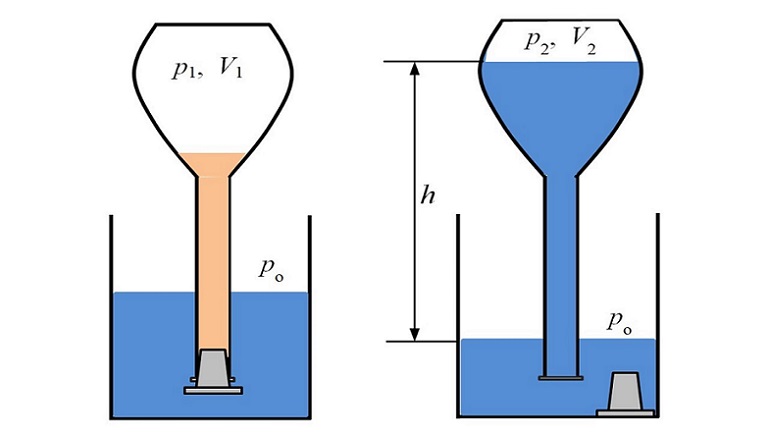
Resumen: Cuando en un recipiente cerrado, lleno en su mayor parte de gas, se lleva a cabo un proceso físico o una reacción química en la que disminuye la cantidad del gas presente, se originará una reducción de la presión que, en las condiciones adecuadas, puede dar lugar al aplastamiento del recipiente bajo la presión de la atmósfera. En este artículo se describe una forma sencilla de conseguir este llamativo resultado mediante una reacción química con materiales de fácil adquisición. Además, se indican algunas aplicaciones didácticas de este experimento, así como un método simple para estimar la disminución de presión que ocurre.
Palabras clave:Dióxido de carbono; Hidróxido sódico; Presión; Reducción de la presión; Fuerzas ejercidas por la atmósfera.
Decrease of pressure in a recipient where carbon dioxide reacts with a basic dissolution
Abstract: When in a closed container, mostly filled with gas, a physical process or chemical reaction takes place producing a decrease of the amount of this gas, a pressure reduction will be caused, which, given the right conditions, can lead to the crushing of the container because of the pressure of the atmosphere. This article describes a simple procedure to achieve this remarkable result using a chemical reaction with materials that can easily be obtained. In addition, some educational applications of this experiment are provided, as well as a simple method to estimate the pressure drop that occurs.
Keywords: Carbon dioxide; Sodium hydroxide; Pressure; Pressure reduction; Forces exerted by the atmosphere.
Downloads
How to Cite
License
Copyright (c) 2018 Los/as autores/as pueden mantener el copyright, concediendo a la revista el derecho de primera publicación. Alternativamente, las/os autoras/es puede transferir el copyright a la revista, la cual permitirá a las/os autoras/es el uso no-comercial del trabajo, incluyendo el derecho a colocarlo en un archivo de acceso libre. Además, se puede consultar Creative Commons sobre licencias de copyright flexibles.

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
Require authors to agree to Copyright Notice as part of the submission process. This allow the / o authors / is non-commercial use of the work, including the right to place it in an open access archive. In addition, Creative Commons is available on flexible copyright licenses (Creative Commons).

Reconocimiento-NoComercial
CC BY-NC
References
Atkins P., Jones L. (1998) Química, 3ª ed. Barcelona: Omega.
Blanco F. (1983) Manual de laboratorio de Química. Salamanca: librería Cervantes.
Brown T., LeMay H., Bursten B. (1998) Química, la ciencia central, 7ª ed. México: Prentice Hall.
Heredia-Avalos S. (2006) Experiencias sorprendentes de química con indicadores de pH caseros. Revista Eureka sobre Enseñanza y Divulgación de las Ciencias 3 (1), 89-103.
IUB (2017) Sodium Hydroxide and Carbon Dioxide: Why it is Important to Keep Your Standard NaOH Solutions Capped. Indiana University Bloomington.
Prolongo-Sarria M. (2013) Trabajos experimentales de química y de física con un estropajo de acero. Anales de Química 109 (1), 45-52.
Resnick R., Halliday D., Krane K. (2002) Física, 4ª ed. México: CECSA.
Shakhashiri B. Z. (1985) Chemical demonstrations. A handbook for teachers of chemistry, Vol. 2. Wisconsin: The University of Wisconsin Press.
Skoog D., West D., Holler F. (1997) Química analítica, 6ª ed. México: McGrawHill.





